Portugalilaisen lääkeyhtiön kliininen koe johti vakavaan onnettomuuteen
Portugalilaisen lääkeyhtiö Bialin kliininen koe on johtanut yhden ihmisen kuolemaan ja viiden vakavaan loukkaantumiseen Ranskassa. Ainakin kolmelle koehenkilöistä arvellaan jäävän pysyvä aivovaurio.
Julkisuuteen tulleiden tietojen mukaan faasin I kliinisessä kokeessa pyrittiin selvittämään rasvahappoamidihydrolaasia (fatty acid amide hydrolase, FAAH) inhiboivan lääkeaineen turvallisuutta terveillä koehenkilöillä. Kokonaisuudessaan kokeeseen otettiin mukaan 128 koehenkilöä, joiden ikä osui 18-55 ikävuoden välille. Yksittäisten annosten turvallisuutta oli jo tutkittu, eikä näissä kokeissa havaittu vakavia haittavaikutuksia. Vakavan haittareaktion saaneet koehenkilöt olivat osa toistetun annostelun koetta, jossa he saivat lääkeainetta suurempina annoksina useamman päivän ajan.
Lääkkeen annostelu aloitettiin kuudelle koehenkilölle 7. tammikuuta. Yksi koehenkilöistä alkoi oireilemaan 10. tammikuuta, jonka jälkeisenä päivänä koe keskeytettiin. Seuraavina päivinä viisi muutakin koehenkilöä joutuivat sairaalahoitoon ja heidän aivoissaan havaittiin magneettiresonanssikuvantamisella nekroottisia leesioita. Ensimmäisenä haittareaktion saanut henkilö menehtyi sairaalassa 17. tammikuuta.
Viiden henkilön tilan kerrottaan olevan vakava mutta vakaa, ja yksi on kotiutettu.
Tutkittavaa yhdistettä annettiin kaikille kuudelle koehenkilölle yhtäaikaisesti. Lehtitietojen mukaan koehenkilöt eivät tässä vaiheessa enää olleet jatkuvan tarkkailun alla. Vuonna 2006 vastaavanlainen yhdenaikaisen annostelun koeasetelma johti kuuden henkilön vakaviin haittavaikutuksiin Britanniassa TGN1412 monoklonaalisen vasta-aineen kliinisessä kokeessa.
Kohtalokkaasti päättyneen kokeen muihin vaiheisiin osallistuneita tutkitaan nyt kiireellisesti uudestaan – toistaiseksi kukaan 18 tutkitusta koehenkilöstä ei kuitenkaan ole osoittanut neurologisia oireita.
Endokannabinoidijärjestelmä lääkekehityksen kohteena
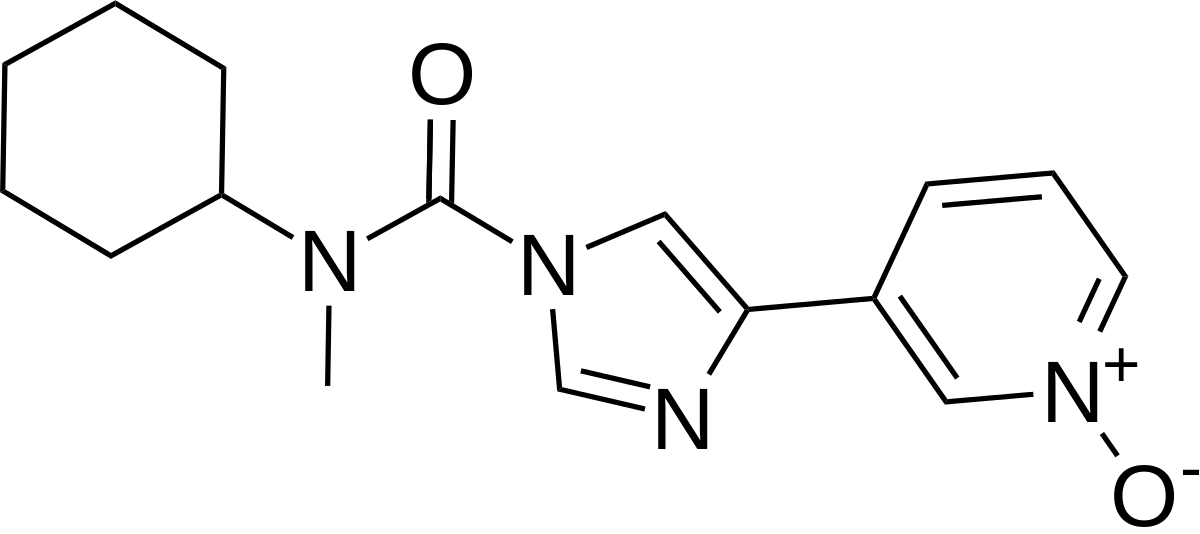
Kokeissa annostellusta lääkeaineesta ei ole annettu tarkempia tietoja, mutta internetissä on päätelty patenttihakemusten perusteella, että kyse on melko todennäköisesti Bialin kehittelemästä BIA 10-2474 –yhdisteestä, joka on siis FAAH-inhibiittori.
Myös monilla muilla lääkeyrityksillä on kehitteillä FAAH-entsyymiin vaikuttavia lääkeaineita. FAAH-entsyymi pilkkoo välittäjäaineina toimivia endokannabinoideja ja sen estäminen johtaa endokannabinoidien kertymiseen elimistöön. Farmakologisesti FAAH-inhibiittorien on ajateltu kuitenkin olevan varsin turvallisia. Tässä tapauksessa lääkeaine on voinut akkumuloituessaan sitoutua esimerkiksi tuntemattomaan kohdeproteiiniin tai sitten annostelussa on tapahtunut virheitä. Onnettomuus on aiheuttanut kuhinaa myös lääkeyhtiöissä ja tiedeyhteisössä – muun muassa Janssen Pharmaceuticals on vapaaehtoisesti lykännyt kehitteillä olevan FAAH-inhibiittorinsa faasin II kliinisten kokeiden toimeenpanoa.
Uutisia aiheesta:
http://www.sciencemag.org/news/2016/01/what-we-know-so-far-about-clinical-trial-disaster-france
http://www.nature.com/news/scientists-in-the-dark-after-french-clinical-trial-proves-fatal-1.19189
http://www.forbes.com/sites/davidkroll/2016/01/18/scientists-speculate-on-what-caused-the-bial-drug-testing-tragedy-in-france/#63a03230301f
http://cen.acs.org/articles/94/i4/Early-Phase-Clinical-Trial-Leads.html
http://www.bioworld.com/content/six-hospitalized-bial-clinical-trial-france-0
Samuel Kohtala
Proviisori, tohtorikoulutettava
www.signatura.fi

Viimeisimmät kommentit